GSK最新解读 mRNA疫苗CMC开发策略与基础软件技术创新的双重奏
全球医药巨头葛兰素史克(GSK)在专业期刊上发表关于mRNA疫苗开发的前沿观点,系统阐述了其从化学、制造与控制(CMC)到基础软件开发的全链条创新策略。这不仅揭示了下一代疫苗技术的核心驱动力,也为生物制药行业的数字化转型提供了关键洞察。
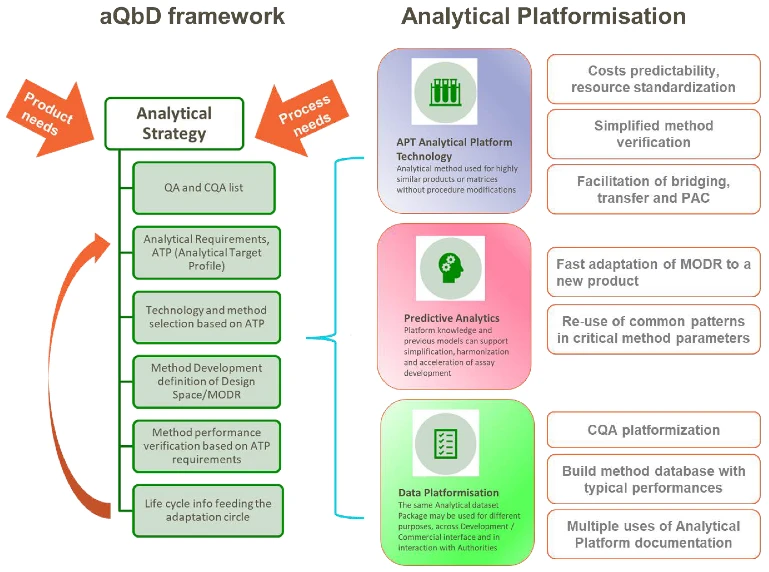
一、CMC开发:从线性流程到集成化敏捷体系
传统的疫苗CMC开发往往遵循线性、阶段性的路径,但mRNA技术的特性要求更灵活、响应更快速的体系。GSK强调的核心策略在于:
- 平台化与模块化设计:将mRNA序列、脂质纳米颗粒(LNP)递送系统、制剂工艺等关键环节模块化。这使得针对不同病原体的疫苗开发能够像“搭积木”一样快速组合与优化,极大缩短早期研发周期。
- 过程分析与质量控制(PAT/QbD)的深度融合:利用先进的过程分析技术,对mRNA的体外转录、纯化、LNP包封等关键步骤进行实时监控与调控。通过质量源于设计(QbD)的理念,将产品质量“内建”于生产过程之中,而非仅仅依赖终产品检验,确保了批间一致性与规模化生产的可靠性。
- 供应链与生产网络的韧性构建:mRNA疫苗的生产涉及质粒DNA、酶、脂质等多种关键原材料。GSK的策略包括开发替代性原料来源、建立区域性生产能力,并利用数字化工具进行供应链可视化与风险预测,以增强应对全球性挑战的韧性。
二、基础软件:赋能研发与制造的“隐形引擎”
GSK文中特别指出,支撑上述CMC策略落地的,是一系列底层软件工具与数据平台的创新。这远非简单的IT支持,而是深度融入科学发现与工程实践的核心驱动力。
- 序列设计与优化算法:开发专有的生物信息学软件,用于mRNA序列的稳定性、翻译效率及免疫原性的预测与优化。算法能够综合考虑密码子偏好、二级结构、GC含量等多种因素,自动生成最优候选序列,大幅提升理性设计能力。
- 过程建模与数字孪生:建立关键制造单元(如生物反应器、微流控混合设备)的数字化模型(数字孪生)。这些模型能够模拟不同工艺参数下的产品关键质量属性(CQAs)变化,用于虚拟实验、工艺优化和故障排查,减少昂贵的实体实验次数,加速工艺锁定。
- 数据集成与智能分析平台:构建统一的数据湖,将来自研发、临床前、CMC、生产乃至临床研究的异构数据(序列数据、工艺数据、分析数据、临床免疫原性数据)进行标准化整合。在此基础上,应用机器学习和人工智能(AI)工具,挖掘隐藏的关联性,例如识别影响疫苗稳定性的关键工艺参数,或预测新抗原序列的免疫效果,形成“数据-知识-决策”的闭环。
- 自动化与高通量实验(HTE)的软件控制:将实验设备(如液体处理工作站、分析仪器)通过软件进行集成与控制,实现质粒构建、mRNA合成与检测等步骤的高度自动化与并行化。软件不仅执行操作,更负责实验设计(DoE)、数据采集与初步分析,将科学家从重复性劳动中解放出来,专注于更高价值的创新。
三、融合创新:CMC与软件的协同进化
GSK的愿景并非将CMC与软件开发视为独立的孤岛,而是强调二者的深度融合与协同进化。
- 软件定义流程:未来的疫苗工艺开发,可能首先在虚拟环境中通过软件模拟完成初步设计与优化,再指导实体实验验证,实现“先模拟,后生产”。
- 数据驱动决策:从研发到生产的全链路数据,通过软件平台流动与分析,为每一个关键决策(如候选分子选择、工艺放大策略、质量控制标准设定)提供实时、量化的证据支持。
- 敏捷响应与持续改进:集成的软件平台使得CMC团队能够快速响应新的科学发现或监管要求,对工艺进行迭代优化,并确保所有变更得到有效管理和追溯。
耀文解读
GSK的此次发文,清晰地勾勒出mRNA疫苗领域竞争的下一个高地:将生物技术的突破与数字技术的深度赋能相结合。卓越的CMC策略确保了疫苗的可开发性、可生产性与质量可靠性,而强大的基础软件生态则是将这些策略高效、精准、规模化落地的“加速器”与“倍增器”。对于行业参与者而言,投资于内部软件开发能力或与顶尖的数字化伙伴合作,已不再是可选项,而是构建未来核心竞争力的必然选择。这场“生物智造”的革命,正由最基础的代码与最前沿的生物分子共同书写。
如若转载,请注明出处:http://www.7gfun.com/product/58.html
更新时间:2026-02-27 02:26:30